Zone à prions dans la protéine Spike des vaccins anti Covid. Convergence de 3 publications (dont une vidéo du Professeur Luc Montagnier)
Quand au début de la pandémie Covid le professeur Montagnier alertait du risque de présence de séquences à prions, les bien-pensants de l’industrie médiatique sont montés au créneau pour le décrédibiliser.
Aucune enquête sérieuse n’a été menée, à part celle menée par l’OMS dans laquelle se trouvait Peter Daszak lamentablement impliquée dans l’affaire du labo de Wuhan.

Plus grave, on a massivement fait vacciner petits et grands sans trop se préoccuper des conséquences éventuelles. Bref, on a refusé de prendre en compte les voix qui sortaient du consensus officiel politico-industriel- académique. On ne prête pas plus attention aux souffrances dues à la vaccination.


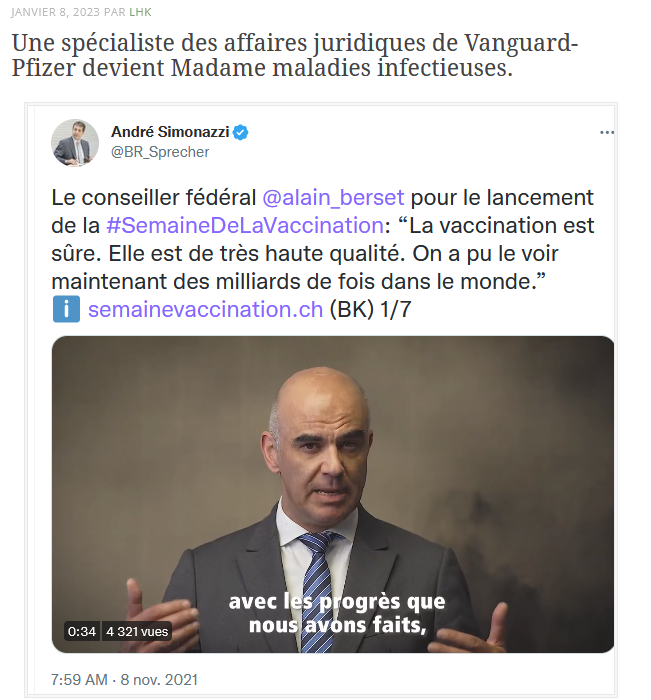
Les scandales se multiplient et pourtant la stratégie politique se poursuit de manière autistique. Souvenons-nous que récemment, le président-ministre de la santé suisse a recruté la responsable des Affaires légales de Pfizer pour diriger la division des maladies transmissibles de l’Office Fédéral de la Santé Publique. Pour s’occuper donc aussi du Covid…
Les 3 études ci-dessous rendent obligatoire la dénonciation de la stratégie de vaccination imposée à des citoyens non avertis des dangers.
La protéine spike du SARS CoV2 peut provoquer des maladies à prions. 3 études ont repéré la séquence responsable.
Le mauvais repliement des protéines prions humaines et des protéines de type prion est largement reconnu comme jouant un rôle causal dans de nombreuses maladies neurodégénératives. Sur la base de preuves expérimentales in vitro et in vivo concernant le prion et maladie de type prion, plusieurs équipes ont cherché ces derniers mois à démontrer de manière irréfutable que la glycoprotéine spike du SRAS-CoV-2 contient des séquences d’acides aminés étendues caractéristiques d’une protéine de type prion pour déduire son potentiel à causer maladie neurodégénérative.
Et ce n’est pas tout. Ces scientifiques démontrent la présence de ces zones à prions dans les vaccins. TOUS les vaccins à ARNm!



L’équipe de Stéphanie Seneff (voir nos billets la concernant) va plus loin et décrit les contributions de la protéine de pointe, via ses propriétés de type prion, à neuro – inflammation et maladies neurodégénératives; aux troubles de la coagulation dans le système vasculaire ; pour aller plus loin risque de maladie dû à la suppression de la régulation des protéines prions dans le contexte d’une résistance à l’insuline largement répandue ; et à d’autres complications de santé. https://assets.cureus.com/uploads/review_article/pdf/129846/20230211-12350-mqqdep.pdf
Témoignage du mari d’une femme atteinte de la maladie de Creuzfeld Jacob.
La publication de l’équipe Montagnier Perez met en exergue la zone à prions dans la spike de SARS CoV 2. TOUS les vaccins en sont chargés
Une publication récente devrait attirer l’attention des autorités sanitaires. Elle nous vient de l’équipe de feu le professeur Nobel Luc Montagnier.
Revenons au contenu de la publication de ce janvier 2023. Les auteurs ont cherché à mettre en évidence la présence d’une région carcérale dans la protéine de pointe du SRAS-CoV-2 d’origine, et dans toutes les variantes de « vaccins » construites à partir du virus de Wuhan.
Nouvelle maladie à prions générée par une séquence à prions dans la région du spike.
Le coup de tonnerre que présente cette publication consiste en la présence d’une zone à prions dans le spike.
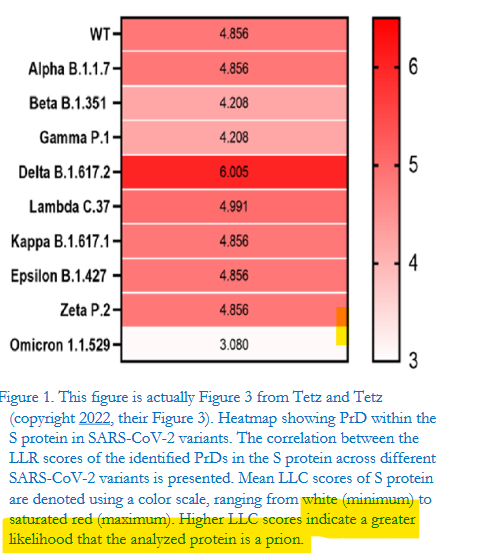
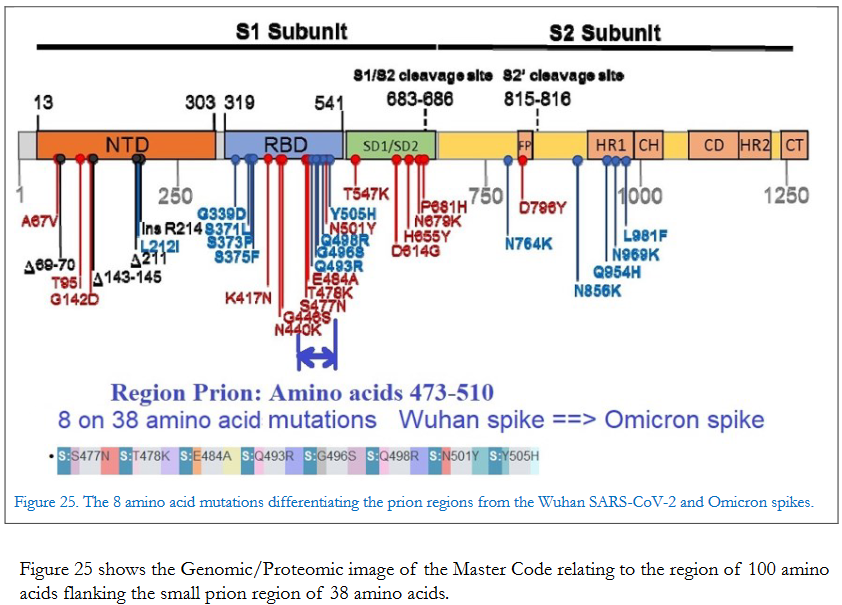
De plus, l’étude confirme la présence d’un spike de wuhan avec prion dans TOUS les vaccins covid y compris le dernier mixant souches wuhan et Omicron.Jean-Claude Perez

De plus, cette région du prion dans la spike du SRAS-CoV-2 a une densité de mutations huit fois supérieure à celle du reste du spike, et pourtant, étrangement, toute cette région du prion disparaît complètement dans la variante Omicron.

Publication de l’équipe de Montagnier (Extraits)
L’étude présente 26 cas de maladie de Creuzfeldt-Jacob, tous diagnostiqués en 2021 avec les premiers symptômes apparaissant dans un délai moyen de 11,38 jours après une injection Pfizer, Moderna ou AstraZeneca COVID-19.
Parce que la progression causale, l’étiopathogénie, de ces cas atypiques et nouveaux de maladie à prion humaine – cas de ce qui est apparemment une forme totalement nouvelle de la maladie de Creuzfeldt-Jacob à évolution rapide – nous nous concentrons sur la chronologie du développement symptomatique. Nous l’envisageons d’un point de vue anamnestique – celui dans lequel nous comparons le développement typique des cas pré-COVID de la maladie de Creuzfeldt-Jacob au développement extrêmement accéléré de symptômes similaires dans les 26 cas examinés. Par une telle approche, nous espérons déterminer l’étiopathogénie essentielle à la compréhension de cette nouvelle maladie à prion humaine qui se développe beaucoup plus rapidement.https://ijvtpr.com/index.php/IJVTPR/article/view/66
En rappelant la voie séquentielle de cette maladie anciennement subaiguë et à évolution lente suivie dans le passé, et en la comparant à cette nouvelle maladie à prion extrêmement aiguë et à évolution rapide – une qui suit généralement de près après deux des injections de COVID-19 – nous croyons il est correct de déduire que les injections ont causé la maladie dans ces 26 cas. Si tel est le cas, ils ont probablement également causé de nombreux autres cas qui n’ont pas été diagnostiqués en raison de leur progression rapide vers la mort.https://ijvtpr.com/index.php/IJVTPR/article/view/66/182
À la fin de 2021, 20 étaient décédés dans les 4,76 mois suivant l’injection incriminée. Parmi ceux-ci, 8 sont décédés subitement dans les 2,5 mois confirmant la progression rapide de cette forme accélérée de la maladie de Creuzfeldt-Jacob. En juin 2022, 5 autres patients étaient décédés et, au moment d’écrire ces lignes, il n’en reste qu’un seul encore en vie. 19 vaccins à ARNm, maladie neuropsychiatrique, évolution du virus COVID
La Nature se débarrasse de ce qui ne lui est pas naturel.
Est-ce que le labo de Wuhan a fabriqué un coronavirus chimérique qui a pour capacité de se fixer sur le récepteur ACE2 dans les cellules humaines? Voilà la question que tout le monde s’est posé dès le début de la pandémie. Le professeur Montagnier a été le premier à s’interroger sur le plateau de CNEWS dès avril 2020. On l’a très vite fait taire en le faisant passer pour un monsieur sénile qui ne savait pas ce qu’il racontait. Le passage où on l’interroge sur l’identité du « on » est savoureuse!
Le prix Nobel avait à l’époque fait référence à une zone à prions, mais aussi à la présence de segments du VIH.
Ce qui est intéressant dans l’étude de janvier est le fait de ne plus trouver cette séquence de prions dans le variant Omicron. Et pour cause, selon les chercheurs français, la Nature se débarrasse de ce qui ne lui est pas naturel.

Rappel: SARS CoV2, un virus augmenté
En juin 2021, nous avions retenu une publication qui de Ariel Fernandez qui expliquait que le virus générateur de Covid-19 était une chimère fabriquée en laboratoire. Il s’appuiait pour ce faire sur la publication d’un journaliste Nicholas Wade qui écrivait en 2021:
« L’approche méthodique a été conçue pour trouver la meilleure combinaison de squelette de coronavirus et de protéine de pointe pour infecter les cellules humaines. L’approche aurait pu générer des virus de type SARS2, et en fait avoir créé le virus SARS2 lui-même avec la bonne combinaison de squelette viral et de protéine spike.
On ne peut pas encore affirmer que Shi a généré ou non le SRAS2 dans son laboratoire car ses dossiers ont été scellés, mais il semble qu’elle était certainement sur la bonne voie pour l’avoir fait.
« Il est clair que l’Institut de virologie de Wuhan construisait systématiquement de nouveaux coronavirus chimériques et évaluait leur capacité à infecter des cellules humaines et des souris exprimant l’ACE2 humain »,Richard H. Ebright, biologiste moléculaire à l’Université Rutgers et expert de premier plan sur biosécurité.
« Il est également clair », a déclaré Ebright, « que, selon les contextes génomiques constants choisis pour l’analyse, ce travail aurait pu produire le SRAS-CoV-2 ou un progéniteur proximal du SRAS-CoV-2. » Le «contexte génomique» fait référence au squelette viral particulier utilisé comme banc d’essai pour la protéine de point. »
https://thebulletin.org/2021/05/the-origin-of-covid-did-people-or-nature-open-pandoras-box-at-wuhan/
Le scientifique argentin, Ariel fernandez, s’est appuyé sur cet article de Nicholas Wade pour émettre l’opinion selon laquelle le SRAS-CoV-2 est le résultat d’une manipulation génétique d’un coronavirus de chauve-souris destiné à promouvoir la transmissibilité à l’homme.https://lilianeheldkhawam.com/2021/06/09/les-preuves-moleculaires-de-la-fabrication-en-laboratoire-du-sars-cov2/comment-page-1/
Etude de Janvier 2022 qui démontre la présence de zone à prions dans la séquence Spike
Quelques jours avant le décès du professeur Montagnier, une étude a été publiée faisant état d’une zone à prions dans la spike du SARS CoV 2:
Les domaines de type prion dans la protéine de pointe du SRAS-CoV-2 diffèrent selon ses variantes et permettent des changements d’affinité pour l’ACE2. Extraits

On peut y lire:
Cependant, les domaines de type prion (PrD) du protéome du SRAS-CoV-2 n’ont pas été analysés. Dans cette étude in silico, utilisant l’algorithme PLAAC, nous avons identifié la présence de domaines de type prion dans la protéine de pointe SARS-CoV-2. Comparé à d’autres virus, une différence frappante a été observée dans la distribution des domaines de type prion dans la protéine Spike puisque:
le SRAS-CoV-2 est le seul coronavirus avec un domaine de type prion trouvé dans le domaine de liaison au récepteur de la région S1 de la protéine de pointe.
La présence et la distribution unique de domaines de type prion dans les domaines de liaison au récepteur du SARS-CoV-2 de la protéine de pointe sont particulièrement intéressantes car bien que les protéines SARS-CoV-2 et SARS-CoV S partagent le même récepteur de cellule hôte, l’angiotensine -converting enzyme 2 (ACE2), le SRAS-CoV-2 démontre une affinité 10 à 20 fois plus élevée pour l’ACE2.
Nous avons identifié des domaines de type prion dans l’hélice α1 du récepteur ACE2 qui interagissent avec le domaine de liaison au récepteur viral du SRAS-CoV-2. Enfin, nous avons trouvé des différences substantielles dans le domaine de type prion de la région S1 de la protéine de pointe entre les variantes émergentes, y compris Omicron (B.1.1.529). Pris ensemble, les présents résultats indiquent que les PrD identifiés dans le domaine de liaison au récepteur SARS-CoV-2 (RBD) et la région ACE2 qui interagissent avec RBD jouent des rôles fonctionnels importants dans l’adhésion et l’entrée virales.
Annexes:
1 Les domaines de type prion dans la protéine de pointe du SRAS-CoV-2 diffèrent selon ses variantes et permettent des changements d’affinité pour l’ACE2
Dans leur introduction les chercheurs reviennent sur le contexte mondial confronté à un nouveau coronavirus (désormais appelé syndrome respiratoire aigu sévère-2 ou SRAS-CoV-2, provoquant la maladie à coronavirus 2019 (COVID-19)) qui s’est [selon le discours officiel] propagé de Wuhan à travers la Chine, et de là le reste du monde.
Le SRAS-CoV-2 est un nouveau membre du genre Betacoronavirus (β-CoV) de grands virus enveloppés à ARN simple brin Ce genre comprend non seulement les virus qui causent des infections humaines mortelles telles que le syndrome respiratoire aigu sévère (SRAS) et le syndrome respiratoire du Moyen-Orient (MERS), mais englobe également les virus qui causent des rhumes non mortels, y compris le coronavirus humain OC43 (HCoV-OC43 ) et le coronavirus humain HKU1 (HCoV-HKU1).
Alors que la pneumonie sévère et la fibrose pulmonaire sont fondamentales pour la pathogenèse du COVID-19, du SRAS et du MERS, ces symptômes ne sont pas typiques des infections causées par HCoV-OC43 et HCoV-HKU1.
Comme d’autres β-CoV, le génome du nouveau virus SARS-CoV-2 code pour les protéines structurelles nécessaires à la formation efficace de virions infectieux ; ceux-ci incluent les protéines de pointe (S), d’enveloppe (E), de membrane (M) et de nucléocapside (N). Le déterminant clé de la spécificité d’hôte des β-CoV est la protéine S située en surface, qui joue un rôle essentiel dans l’infection en médiant l’attachement viral aux récepteurs de surface des cellules hôtes et en facilitant l’entrée virale.
La protéine S est constituée de deux grandes régions : la N-terminale S1 et la C-terminale S2. S1 est responsable de la reconnaissance des récepteurs de la cellule hôte, y compris le domaine de liaison au récepteur (RBD), et présente une variabilité de séquence plus élevée que S2 (S1 partage environ 70 % d’identité avec celle d’autres β-CoV humains). La région S2 intégrée à la membrane responsable de la fusion est plus fortement conservée que celle de S1.
Dans le SRAS-CoV-2, le RBD dans S1 permet au virus de se lier directement au domaine peptidase du complexe hôte de l’enzyme de conversion de l’angiotensine 2 (ACE2), médiant l’entrée du virus dans les cellules sensibles.
Notamment, par rapport au SARS-CoV, le SARS-CoV-2 a une affinité de liaison plus élevée pour l’ACE2 (qui est le récepteur commun du SARS-CoV-2 et du SARS-CoV), avec une interaction plus large avec l’ACE2 (suggérée en raison de la dynamique basés sur les mouvements corrélés et les perturbations de l’énergie électrostatique) exprimées non seulement dans les poumons mais aussi dans les reins, les testicules et le cœur [
Des mutations dans la séquence du génome du SARS-CoV-2 sont responsables de l’émergence de nouveaux variants du SARS-CoV-2, dont beaucoup se caractérisent par des taux de transmission plus élevés.
Récemment, nous avons effectué une analyse et identifié pour la première fois des domaines viraux de type prion (PrD), qui, selon nous, sont de nouveaux régulateurs de l’assemblage du virion ayant un rôle à jouer dans les interactions virus-cellule hôte.
Ces études étaient conformes aux études précédentes, montrant qu’en plus du rôle pathologique que jouent les prions chez l’homme – étant impliqués dans les maladies d’Alzheimer et de Parkinson, le diabète et de nombreuses autres pathologies humaines – le mauvais repliement des protéines joue également des rôles physiologiques importants chez les eucaryotes et les procaryotes
2.Maladies à prion
À propos des maladies à prion
Les maladies à prion sont des troubles dégénératifs rares et fatals du cerveau qui se produisent dans le monde entier chez les humains et les animaux. Elles appartiennent à la catégorie générale de maladies cérébrales appelées protéinopathies, qui incluent la maladie d’Alzheimer, la maladie de Parkinson et la sclérose latérale amyotrophique (SLA). Bien qu’il y ait plusieurs formes de maladies à prion, la plus courante est la maladie de Creutzfeldt-Jakob (MCJ). Le sigle MCJ est souvent utilisé pour désigner toutes les formes de la maladie à prion humaine. Quant aux maladies à prion qui touchent les animaux, on compte l’encéphalopathie spongiforme bovine (ESB) chez les bovins, la tremblante du mouton chez les moutons et les chèvres, ainsi que la maladie débilitante chronique des cervidés (MDC) chez les cerfs, les orignaux, les wapitis et les caribous. Bien que ces maladies soient rares, elles ont causé de graves préoccupations en matière de santé publique en raison de leurs nombreuses caractéristiques inhabituelles et difficiles.
Comment les maladies à prion affectent-elles le cerveau?
Le cerveau des humains et des animaux atteints d’une maladie à prion subit des lésions appelées « changement spongiforme » ou « spongiose », car à l’examen au microscope, le tissu ressemble à une éponge percée de nombreux petits trous. En outre, le tissu cérébral contient des dépôts anormaux d’une protéine particulière appelée protéine prion (PrP). Ces atteintes pathologiques peuvent être causées par des variations génétiques ou survenir de façon spontanée chez une même personne. Elles peuvent toutefois résulter d’une transmission infectieuse entre des individus de la même espèce ou d’espèces différentes.
Protéines prion comme agents infectieux
On ne croit pas que l’agent infectieux des maladies à prion soit une bactérie, un virus ou un parasite. En effet, la plupart des scientifiques croient plutôt qu’il s’agit d’une forme anormale de la protéine prion (PrP). La forme normale de la PrP (PrPc) est présente chez tous les humains et animaux en santé. Cependant, lorsque survient une maladie à prion, une ou quelques molécules PrPc sont, pour une raison ou une autre, transformées en une forme infectieuse anormale ou prion (particule protéique infectieuse). Les molécules anormales peuvent alors convertir la plupart des molécules PrPc d’une même personne ou d’un même animal en la forme anormale, ce qui entraîne une maladie neurologique. Dans certaines circonstances (comme lors d’interventions médicales effractives ou d’une exposition à des aliments contaminés par l’ESB), les maladies à prion peuvent être transmises, car dans certains cas, le contact avec du matériel contaminé par des prions, même dans une infime proportion, peut déclencher ce processus chez les personnes saines.
https://www.canada.ca/fr/sante-publique/services/maladies/maladies-a-prion.html
Source : Liliane Held-Khawam

Laisser un commentaire