Anticorps mono / polyclonaux : la première médecine, ne pas tout gober
Regeneron, Molnupiravir, Xav-19 et autres traitements sont vantés comme des solutions miracle contre le grand méchant virus. Mais que se cache t’il derrière ces médicaments ? Les anticorps monoclonaux et polyclonaux. Cet article est avant tout un résumé de plusieurs articles scientifique.
Regeneron, Xav-19 et autres traitements sont vantés comme des solutions miracle contre le grand méchant virus. Il s’agit de traitements par anticorps monoclonaux ou polyclonaux.
Fabriqués en laboratoire à partir de sang animal, les scientifiques misent énormément sur ce type de biothérapie. Leur nombre sur le marché ne cesse d’augmenter. Le contexte sanitaire actuel, ainsi que la loi bioéthique permettent leur prolifération.
On peut encore le constater avec une nouvelle autorisation de mise sur marché de 2 nouveaux traitements contre le grand méchant virus.
Mais peut on réellement prendre ce genre de traitement comme on prendrait un simple doliprane ?
La réponse est clairement non, l’utilisation des biomédicaments étant contrainte à des mesures réglementaires pour l’utilisation des biomédicaments. N’en déplaise à certaines, c’est encore (un peu) le cas aujourd’hui.
Dans leur rapport » Mécanismes d’action et toxicité potentielle des anticorps monoclonaux (AcM), Théodora Bejan-Angoulvant et Joachim Alexandre, dressent une liste, bien entendu non exhaustive des effets secondaire liés à ce type de traitement.
Ces effets sont aussi nombreux et variés que le nombre d’AcM !!! Ils ont donc répertoriés certains effets secondaire par « type », extrait :
Étant donné la multiplicité des AcM et de leurs cibles, il est en fait difficile de faire une synthèse de tous les effets indésirables ; c’est la raison pour laquelle nous avons fait le choix dans cette revue, de présenter certains de ces effets indésirables, groupés par type. »
Est aussi mentionné le dépistage des effets secondaire POST COMMECRIALISATION, autrement dit, des effets secondaire en pagaille sont attendus après la commercialisation !!
Vous constaterez que toute ressemblance à une grande partie des effets secondaire des vaccins n’est certainement due qu’à un grand hasard.
En vrac, cela peut aller à des douleurs au point d’injection, fièvre (dûe à un pic de cytokine), frissons, nausées, vomissements, hypotension, dyspnée, affaiblissement, perte du système immunitaire, risque de réinfection, effets indésirables cardiovasculaires, mais également rénaux, thyroïdiens ou touchant le tube digestif.
Les principaux effets indésirables cardiovasculaires observés avec les AcM anti-VEGF sont une élévation de la pression artérielle, allant jusqu’à une hypertension artérielle de sévérité variable, des accidents ischémiques artériels (infarctus du myocarde, accident cérébro-vasculaires), insuffisance cardiaque, des accidents hémorragiques, une dysfonction ventriculaire gauche pouvant aller jusqu’à une insuffisance cardiaque, des accidents thromboemboliques veineux.
D’autres effets indésirables ont également été décrits, comme une protéinurie ou un défaut de cicatrisation.
On peut aussi ajouter à cette liste d’effets secondaire, la thrombocytopénie, une apparition ou aggravation des maladies auto immunes, comme la polyarthrite, altération du foie, ou encore des problèmes neurologiques, notamment l’axe hypothalamo – hypophysaire. Les AcM et leurs multiples effets secondaires sont un facteur de stress majeur.
1/ Qu’appelle t’on anticorps monoclonal, anticorps polyclonaux, comment sont ils produit ?
Les anticorps monoclonaux sont conçus en laboratoire. Tout comme pour les anticorps que votre système immunitaire fabrique, leur travail est de déclencher une réaction du système immunitaire. Certains anticorps monoclonaux trouvent un antigène spécifique, comme une protéine, sur une cellule cancéreuse et s’y lient. Le système immunitaire sait alors qu’il doit attaquer et détruire ces cellules.
Les anticorps thérapeutiques monoclonaux (AcM) sont considérés comme le plus important « progrès » pharmacologique et thérapeutique des 20 dernières années. Ce progrès est marqué non seulement par le nombre croissant de ces anticorps qui sont mis sur le marché mais également par le nombre croissant des cibles antigéniques que ces anticorps reconnaissent.
Pour le moment, les différents biomédicaments sont principalement administrés par voie intraveineuse ou par voie sous cutanée.
Sous forme de biothérapie, les anticorps favorisent la destruction et l’élimination de pathogènes cibles, comme ils le feraient sous influence du système immunitaire. Mais les anticorps ne ciblent plus uniquement ce qui est anormal ou étranger. Ils peuvent également viser et bloquer des protéines natives d’intérêt . « Pour soulager des maux de tête, l’aspirine se lie à une protéine du corps qui soulage la douleur, » explique le professeur Gary Stephens, de la Reading School of Pharmacy. « Les anticorps peuvent agir de manière similaire. Mais leurs propriétés inhérentes leur permettent de se lier très fortement et avec une très grande affinité à leur cible. Ils sont donc probablement plus puissants que les médicaments. » La production de ces anticorps est plus délicate, puisqu’il faut que le modèle animal producteur exprime la protéine native cible avec la meilleure homologie de séquence possible (sauf pour les cibles virales et microbiennes).
Les animaux transgéniques, humanisés ou des espèces proches de l’humain, comme les primates sont particulièrement pertinents dans ce cas.
Le sérum animal, la base des anticorps thérapeutiques.
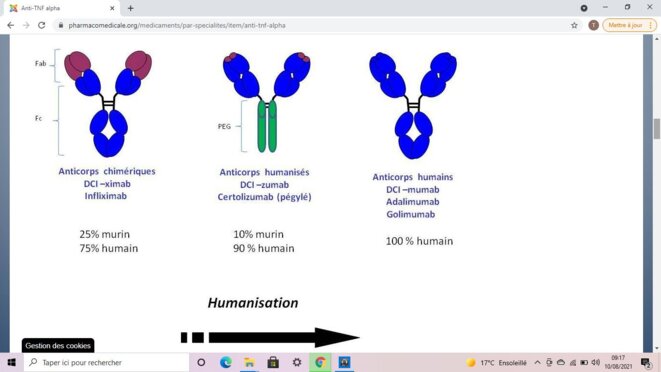
Exemple de traitement, le Simponi Golimuab, en phase « test » contre la polyarthrite >> Anticorps MONOCLONAL HUMAIN de type IgG1Kappa produit sur une lignée CELLULAIRE d’HYBRIDOME de SOURIS par la technique de l’ADN RECOMBINANT … Substrat d’origine : PROTEINES de SOURIS
Les anticorps monoclonaux ou polyclonaux sont fabriqués en laboratoire à partir de sérum animal, comme celui de la souris. Plus simples à obtenir que les anticorps monoclonaux, les anticorps polyclonaux sont obtenus en immunisant un animal (par exemple un lapin, une chèvre, une souris, un lama…) à plusieurs reprises avec une préparation d’antigènes et un adjuvant, afin d’augmenter sa réponse immunitaire. Lorsque la production d’anticorps devient importante, le sang de l’animal est récupéré et les anticorps sont purifiés au laboratoire.
En combinant des ADN de souris (provenant d’hybridome) avec des ADN issus de gènes codant des anticorps humains, il devient possible de créer des anticorps plus proches encore des anticorps humains. A la différence des techniques traditionnelles basées sur les immunisations d’animaux, ces anticorps monoclonaux chimériques permettent la production d’une grande quantité d’anticorps sans contaminant car ils sont produits à partir de gènes synthétiques exprimés in vitro en cellules mammifères ou in vivo en utilisant des hybridomes.
Du fait de la variabilité des anticorps récoltés, les préparations à base de sérum animal, ont eu tendance initialement à être elles-mêmes très immunogènes chez l’humain, induisant parfois des réponses immunitaires violentes voire même des chocs anaphylactiques. La découverte de la pénicilline par Fleming en 1928 et autres antibiotiques, beaucoup moins chers et sûrs pour lutter contre les infections, jette alors une ombre sur la sérothérapie, en grande partie abandonnée à cette époque.
L’intérêt pour les anticorps thérapeutique reprend après 1977 avec la mise au point des hybridomes par César Milstein et Georges Köhler permettant d’obtenir une grande quantité d’anticorps à faible coût. Après injection d’un antigène d’intérêt chez la souris, les cellules de rate, plus spécifiquement les plasmocytes qui sécrètent des anticorps dirigés contre l’antigène choisi, sont prélevées et cultivées. Les hybridomes sont obtenus en fusionnant ces plasmocytes avec des cellules de tumeur appelées cellules myélomateuses (cellules immortelles). Comparativement aux cellules productrices d’anticorps d’un organisme, ces hybridomes sont capables de se multiplier plus rapidement et de développer indéfiniment des anticorps spécifiques. Il est ainsi possible de cultiver perpétuellement un clone de cellules productrices d’un seul type d’anticorps pour assurer une production constante dans le temps.
Les anticorps issus de ces hybridomes de souris sont rapidement perçus comme une renaissance de l’ancienne sérothérapie animale, et ont ouvert de nombreuses perspectives dans l’identification précise de structures antigéniques, la purification de substances et le diagnostic. Le premier anticorps monoclonal thérapeutique, le muromonab-CD3, fut ainsi autorisé dès 1986 en tant qu’immunosuppresseur pour prévenir les rejets de greffes.
2/ Quels sont certains effets secondaire de ce type de traitements ?
La liste est … longue.
Les effets indésirables des AcM sont très majoritairement des effets liés à leur mécanisme d’action, donc à l’action qu’ils ont sur leur cible (on target). Quand la cible et son rôle sont connus, les effets indésirables des AcM peuvent être anticipés dès leur phase de développement (toxicité prévisible).
Cependant, pour beaucoup d’AcM, les conséquences de leur action sur la cible sont souvent peu connues, principalement en raison de la méconnaissance de la distribution et du rôle de la cible dans l’organisme, de l’absence de prévisibilité de la nature ou de l’intensité des effets liés à une interaction complexe avec le système immunitaire, ou encore avec les anticorps anti-point de contrôle immunitaire et de leurs effets dysimmunitaires. Il s’agit donc d’effets indésirables non prévisibles et qui sont inattendus lors de la commercialisation.
La surveillance post-commercialisation des AcM aura ainsi pour objectif de dépister les effets indésirables non attendus et d’évaluer leur mécanisme, puis d’estimer leur incidence et sévérité, d’optimiser leur dépistage et prise en charge de façon à optimiser la balance bénéfices / risques. Étant donné la multiplicité des AcM et de leurs cibles, il est en fait difficile de faire une synthèse de tous les effets indésirables ; c’est la raison pour laquelle nous avons fait le choix dans cette revue, de présenter certains de ces effets indésirables, groupés par type.
Réactions liées à la perfusion (ou à l’injection)
Les réactions liées à la perfusion des AcM sont fréquentes. Elles apparaissent le plus souvent dans les 30 minutes à 2h après le début de la perfusion de l’anticorps et surviennent généralement lors des premières injections. Elles peuvent être plus rarement tardives, jusqu’à 24 à 72h après la fin de la perfusion.
Même si ces réactions à la perfusion sont le plus souvent légères, elles peuvent parfois présenter des symptômes évocateurs de réactions d’hypersensibilité: bronchospasme, urticaire, hypotension. Les mécanismes sous-jacents à ces réactions restent encore largement inconnus. Les réactions de relargage de cytokines sont un des mécanismes supposés. Elles seraient liées à l’interaction entre l’AcM avec sa cible antigénique exprimée sur des cellules sanguines circulantes, des cellules tumorales ou des cellules effectrices du système immunitaire recrutées au site tumoral.
C’est, par exemple, le cas des premières perfusions de rituximab pour lesquelles les réactions ont été corrélées à l’activation du complément et au nombre de lymphocytes B circulants, et à un pic de cytokines (TNF-α et IL[interleukine]-6) observé après 90 minutes de perfusion, associé aux symptômes habituellement décrits avec un relargage de cytokines: fièvre, frissons, nausées, vomissements, hypotension et dyspnée.
Ce fut aussi le cas, de façon bien plus massive, chez 6 volontaires sains ayant reçu, dans un essai de phase I, le TGN1412, un anti-CD28 « super-agoniste » de ce récepteur stimulant les lymphocytes T: tous les volontaires ont développé une défaillance multi- organes .
Ces réactions (cytokiniques ou allergiques) peuvent aussi survenir lors de l’administration sous-cutanée (SC) des AcM, dans les 24 heures ou plus retardées. Cependant, l’administration SC est le plus souvent associée à des réactions cutanées (érythème, prurit, éruption) ou locales (douleur, rougeur, gonflement) peu sévères et transitoires.
Risque infectieux
Plus de la moitié des AcM actuellement sur le marché ciblent un antigène qui est exprimé par les cellules du système immunitaire ou hématologique, et la très grande majorité d’entre eux contiennent une région Fc d’IgG1 qui interagit avec les RFcg exprimés par un grand nombre de cellules du système immunitaire, notamment les cellules myéloïdes. De plus, un nombre non négligeable de ces AcM ciblent des antigènes membranaires exprimés par ces cellules, conduisant à leur destruction ou leur modulation. Il est donc attendu que ces interactions immuno-pharmacologiques soient susceptibles de perturber la fonction de ces cellules, en particulier, leur activité de défense contre les pathogènes: perturbation de leurs fonctions effectrices, déplétion des lymphocytes B ou T, ou inhibition de la production de cytokines. Ainsi, un risque infectieux est très souvent décrit dans les essais cliniques évaluant un AcM. Il constitue l’une des principales raisons de l’établissement de mesures réglementaires pour l’utilisation des biomédicaments [avertissement encadré dans le RCP (résumé des caractéristiques du produit) ou « black box warning », lettres aux professionnels de santé]. Ce sur-risque est plus précisément décrit et évalué lorsque la cible antigénique ou la cellule qui l’exprime a un rôle particulièrement bien documenté dans la défense contre les pathogènes.
Le complément joue également un rôle majeur dans les défenses antibactériennes, soit directement, pour les bactéries Gram négatives, soit par activation du système immunitaire et phagocytose pour les autres pathogènes. Les déficits congénitaux, mais aussi l’inhibition des voies d’activation du complément par l’éculizumab qui inhibe le composant C5 du complément, sont associés à un risque accru d’infections à bactéries encapsulées, notamment de méningites à méningocoque. Le risque d’infections à méningocoque a été estimé chez les patients traités à 1,5 % (soit une augmentation de risque de 10 000 fois par rapport à la population générale), et cela malgré une vaccination préalable recommandée.
Il y’a aussi un risque de réinfection virale, notamment concernant l’inhibition du passage des lymphocytes T au travers de l’endothélium vasculaire, empêchant ainsi leur action antivirale dans le système nerveux central.
Effets indésirables cardiovasculaires
Trois anticorps thérapeutiques aujourd’hui commercialisés, conduisent à l’inhibition de la voie du VEGF, principal facteur de croissance impliquée dans la néo-angiogenèse pathologique: le bévacizumab et ses biosimilaires, qui ciblent le VEGF-A circulant, utilisés en cancérologie ; le ranibizumab, également spécifique du VEGF-A, utilisé dans des pathologies rétiniennes (en injections intravitréennes), et le ramucirumab ciblant le VEGFR-2, un récepteur tyrosine kinase de type 2 du VEGF-A utilisé en cancérologie. Le VEGF a un rôle fondamental dans le maintien de la fonction et la trophicité des vaisseaux sanguins et du myocarde, dans la régulation de la pression artérielle, mais aussi dans d’autres organes, comme le rein, le foie, le tube digestif ou la thyroïde.
Le blocage de la voie du VEGF peut ainsi être à l’origine d’effets indésirables cardiovasculaires, mais également rénaux, thyroïdiens ou touchant le tube digestif. Les principaux effets indésirables cardiovasculaires observés avec les AcM anti-VEGF sont une élévation de la pression artérielle, allant jusqu’à une hypertension artérielle de sévérité variable, des accidents ischémiques artériels (infarctus du myocarde, accident cérébro-vasculaires), des accidents hémorragiques, une dysfonction ventriculaire gauche pouvant aller jusqu’à une insuffisance cardiaque, des accidents thromboemboliques veineux. D’autres effets indésirables ont également été décrits, comme une protéinurie ou un défaut de cicatrisation.
Le rôle délétère du TNF-α à forte concentration sur la fonction ventriculaire gauche dans l’insuffisance cardiaque avait été suggéré dans plusieurs études précliniques et chez l’homme. Plusieurs essais cliniques, conduits chez des patients ayant une insuffisance cardiaque à fraction d’éjection gauche altérée, ont permis d’évaluer, comparativement à celui d’un placebo, l’effet d’un anticorps anti-TNF-α, l’infliximab, sur cette altération cardiaque. L’étude ATTACH, utilisant deux doses de l’anticorps, n’a pas montré de bénéfice clinique dans l’insuffisance cardiaque. Elle a même révélé un effet délétère sur la mortalité et les hospitalisations pour insuffisance cardiaque dans le groupe ayant reçu la plus forte dose de l’AcM (10 mg/kg). Cette observation a conduit à contre-indiquer les anticorps anti-TNF-α chez les patients ayant une insuffisance cardiaque à fraction d’éjection altérée, correspondant au stade III/IV dans la classification de la New York heart association (NYHA).
Autres effets indésirables
Une toxicité cutanée, le plus souvent de type éruption acnéiforme du visage et de la partie supérieure du tronc, a été observée chez plus de 80 % des patients traités par le cétuximab ou le panitumumab.
Avec l’abciximab, anticorps chimérique reconnaissant la glycoprotéine IIb/IIIa plaquettaire, bloquant la fixation du fibrinogène, du facteur Willebrand et d’autres molécules d’adhérence aux plaquettes activées, une thrombocytopénie aiguë a été décrite. Elle survient chez 1 % des patients traités, dans les heures suivant le début de la première perfusion, probablement en raison de la présence d’anticorps préexistants dirigés contre des épitopes murins exposés par l’anticorps. La fréquence de cette thrombocytopénie est plus élevée après la deuxième perfusion (touchant environ 10 % des patients), et peut survenir de façon retardée, jusqu’à une semaine après cette perfusion. Elle semble être liée au développement de nouveaux anticorps dirigés également contre des épitopes murins de la région Fab de l’anticorps (anticorps anti-anticorps). Une thrombocytopénie, dont le mécanisme pourrait être similaire, a été également décrite avec d’autres AcM (infliximab, rituximab, éfalizumab).
En interagissant avec le système immunitaire, les AcM pourraient être en cause dans l’apparition d’un certain nombre d’effets indésirables auto-immuns. Par exemple, le traitement par des anticorps anti-TNF-a a été associé à l’apparition d’autoanticorps anti-nucléaires et anti-ADN, et, dans de très rares cas, à des manifestations cliniques auto-immunes de type lupus. D’autres manifestations auto-immunes, de type psoriasis ou de type maladies démyélinisantes, ont également été décrites, mais elles sont à considérer avec précaution, la pathologie sous-jacente pouvant également être un facteur de risque de manifestations auto-immunes.
Le risque de cancer associés à l’utilisation des anticorps anti-TNF-a reste controversé. Dans une méta-analyse, un sur-risque de cancer a été retrouvé, mais plusieurs autres publications, y compris des études de vraie vie, n’ont pas révélé d’augmentation du risque de cancers solides, ni de lymphomes. Des incertitudes persistent pour le risque de mélanome ou d’autres cancers de la peau.
3/ Traitement par inhibiteur de point de contrôle :
Le système immunitaire empêche normalement les cellules T, un type de cellule immunitaire, d’attaquer les cellules normales en ayant recours à des protéines appelées points de contrôle. Les points de contrôle font partie d’une voie de signalisation que le système immunitaire emprunte pour ralentir, ou freiner, une réaction immunitaire. Certaines cellules cancéreuses peuvent envoyer des signaux qui embrouillent les cellules T en activant une voie de signalisation des points de contrôle et en les empêchant d’attaquer les cellules cancéreuses. Cela permet au cancer de continuer à se développer puisque les cellules cancéreuses se cachent du système immunitaire.
Les inhibiteurs du point de contrôle immunitaire sont des anticorps monoclonaux qui bloquent les protéines spécifiques des points de contrôle, permettant ainsi aux cellules immunitaires d’attaquer et de détruire les cellules cancéreuses.
4/ Petit Bonus : Présentation de ProteoGenix, par … ProteoGenix, société basée à Schiltigheim, un des leaders mondial d’anticorps mono et polyclonaux.
Secteur d’activité : recherche dans l’industrie biopharmaceutique, spécialisée dans la production d’anticorps.
ProteoGenix, fondée en 2003, est l’un des leaders mondiaux de la production d’anticorps.
Nos solutions intégrées des gènes aux agents biothérapeutiques et aux diagnostics font de nous le partenaire de prédilection de l’industrie pharmaceutique et des biotechnologies pour le développement d’anticorps thérapeutiques et d’essais à façon :
– Génération d’anticorps avec conception d’antigène : technologie de l’hybridome ou du phage display
– Ingénierie d’anticorps : humanisation, maturation d’affinité, reformatage (anticorps bispécifiques, ADC…), commutation isotypique et de sous-classe…
– Production d’anticorps : production d’anticorps monoclonaux recombinants, développement de lignées cellulaires stables…
– Production de protéines :E. coli, B. subtilis, levure, cellules d’insecte/mammifère
– Synthèse de peptides à façon
– Synthèse de gènes à façon
Pour quelle application avez-vous besoin d’un anticorps monoclonal ? Cliquez sur les applications ci-dessous pour découvrir le contenu et les garanties de nos formules de développement d’hybridomes. Rien de plus facile, la société ProteoGenix, basée à Schiltigheim, est là pour vous servir (modification génétique, d’ADN, cellulaire, clonage de souris pour vous concocter la meilleure application possible )
Service Garanti 100% personnel, différents pack sont disponibles selon vos « projets ». Voici, par exemple, le contenu du package prémium garanti en Elisa sandwich : ATX-PACK5M
>> Design de l’antigène (conception du fragment le plus approprié à produire)
>> 2 synthèses de gènes (chaque gène étant optimisé pour un système d’expression spécifique) et 2 sous-clonages
>> Tests d’expression dans 2 systèmes parmi E. coli, B. subtilis, P. pastoris, cellules d’insectes et cellules de mammifères. Choix des systèmes réalisé par ProteoGenix.
>> Production de l’antigène dans le système d’expression le plus approprié, en fonction du rendement et des besoins spécifiques du projet.
>> Immunisations de 5 souris
>> Contrôle de la réponse immunitaire en ELISA
>> Sélection des 2 meilleures souris pour réaliser 2 fusions afin d’obtenir un grand nombre et une grande diversité de clones.
Criblage du produit de fusion en ELISA : environ 10 plaques 96 puits
>> Sous-clonage de 10 clones parentaux (2-3 séries de dilutions limites) + criblages en ELISA
>> Production et purification de 2 mg d’anticorps à partir des 10 meilleurs clones
>> Couplage des 10 anticorps à la Biotine, HRP ou AP
Test des 90 possibilités de combinaison en ELISA Sandwich
ProtéoGenix à l’assault du grand méchant virus
Quelques définitions :
Anticorps :
Un anticorps est une substance de défense produite par certains globules blancs en réaction à une substance étrangère, un antigène. L’anticorps la reconnaît comme n’appartenant pas à l’individu et la détruit.
Cytokines :
La cytokine est une petite protéine libérée par des cellules humaines en réaction à une infection bactérienne; elle peut provoquer directement ou indirectement de la fièvre, des douleurs ou la multiplication des lymphocytes T. Toutes molécules jouant le rôle de médiateur cellulaire sont des cytokines, lesquelles sont émises par des cellules isolées et ont une action essentiellement locale, de type autocrine ou paracrine.
Certaines cytokines interviennent dans l’inflammation et l’immunité, d’autres jouent un rôle dans la division et la différenciation cellulaires et d’autres possèdent des propriétés antivirales. Les cytokines font l’objet d’études pour le traitement des cancers, des maladies auto-immunes et du SIDA.
Les lymphocytes :
Les lymphocytes sont un type de globules blancs qui jouent plusieurs rôles dans le système immunitaire, notamment la protection contre les bactéries, les virus, les champignons et les parasites. Les lymphocytes constituent généralement 20 à 40 % des globules blancs du sang.
Il existe trois types de lymphocytes, les cellules B (lymphocytes B), les cellules T (lymphocytes T) et les cellules tueuses naturelles (cellules NK).
Source : Blogs Médiapart

Laisser un commentaire